İçindekiler
Tanım
Otofaji, hücresel yıkımın ve dönüşümün olduğu bir hücre ölüm mekanizmasıdır. Evrimsel olarak bütün ökaryot canlılarda korunmuş olan bu sistem, hücresel gelişimin kritik aşamalarında rol oynayan ve oluşan besin stresine yanıt olarak enerji kaynaklarını dengeleyen bir sistemdir [1].
Açıklama
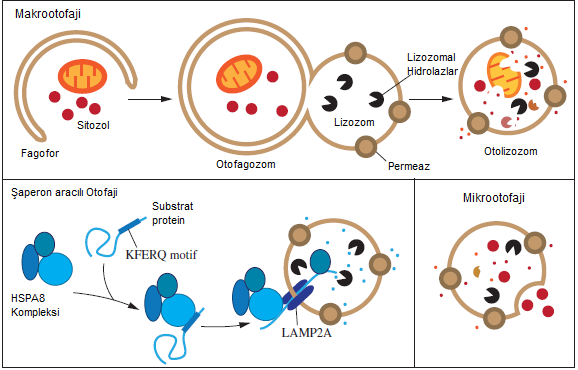
Otofajik hücre yıkımı kendi kendini yiyen bir süreçtir denilebilir. Bu süreçte, hücre içi makromoleküllerin yıkılması ile ortaya çıkan parçaların lizozom tarafından sindirilmesi gibi işlemler yer almaktadır. Ayrıca otofaji, hatalı katlanmış ya da birikmiş proteinlerin ortadan kaldırılmasında, hasarlı organellerin imhasında ve hücre içi patojenlerin uzaklaştırılmasında da görev almaktadır [2]. Bu bakımdan otofaji, hücre korunumunda önemli bir role sahiptir. Memeli hücrelerinde üç tip otofajinin olduğu bilinmektedir. Bunlar mikrootofaji, makrootofaji ve şaperon aracılı otofaji (CMA) olarak sıralanabilir [3]. Bu üç otofaji tipi de morfolojik olarak birbirlerinden farklıdır.
Mikrootofaji
Mikrootofaji genel itibariyle sitoplazmik içeriğin lizozoma fagosite etmesi ile gerçekleşmektedir [4]. Yani burada, sitoplazmik parçaların veziküller aracılığıyla lizozoma alınarak imha edilmesi söz konusudur. Mikrootofaji bu yönden aynı zamanda endozom aracılı mikrootofaji olarak da adlandırılmaktadır. Bu çoklu veziküler endozomlar, çözünebilir olan sitozolik proteinleri lizozoma taşırlar [5]. Mikrootofaji hakkında detaylı bilgiler mevcut olmasa da bu otofaji çeşidinin sağlık durumlarında ve hastalıklarda rol oynayabileceği düşünülmektedir.
Makrootofaji
Makrootofaji, mikrootofaji ve CMA’dan biraz farklıdır. Makrootofajide ilk ayrılma bölgesi lizozom membranından uzak bir bölgede meydana gelir. Daha sonrasında bu bölgedeki organel parçalarını taşıyan sitozolik veziküller kargo görevi görerek lizozoma hareket eder. Bu morfolojik farklılıkta rol oynayan bu veziküller, otofagozom olarak adlandırılır. Aynı zamanda vezikül aracılı trafik sürecinin kendisi de başlı başına bir otofagozom sürecidir [6]. Memeli hücrelerinde otofagozom oluşumu sitoplazmanın birçok yerinde meydana gelmektedir. Ayrıca yapılan bazı çalışmalar “omegazom” adı verilen ER ilişkili yapıların da otofajide başlangıç bölgeleri olarak işlev gördüğünü göstermektedir [7].
Başlangıcı takip eden süreçte fagofor adı verilen membranımsı (zarımsı) yapı genişlemeye başlar. Bu aşamada çift membranlı kısmın oluştuğu görülmektedir. Bu membranın kaynağı konusunda çeşitli teoriler ortaya atılsa da genel kanı plazma membranı [8], ER [7], golgi kompleksi [9] veya mitokondriden [10] oluştuğudur. Fagofor genişledikçe küresel bir yapı olan otofagozom oluşmaya başlar. Otofagozom oluştuktan sonra içerdiği kargo vezikülleri lizozoma taşınmak zorundadır. Lizozoma ulaştığında otofagozom membranı lizozom membranına füzyon ederek içerdiği kargo vezikülleri lizozom içerisine aktarır [3]. Lizozom ise içerdiği hidrolaz, proteaz gibi enzimlerle kendisine aktarılan hücre parçalarını sindirir [3].
Makrootofaji mekanizması, başlatım (indüksiyon), çekirdeklenme (nükleyazasyon) ve genişleme (elongasyon) şeklinde üç aşamayı içermektedir. Bu aşamalar füzyon aşamasından önceki aşamaları içermektedir [3].
Şaperon aracılı Otofaji
Şaperon aracılı otofaji (CMA), diğer otofaji türlerine göre oldukça spesifiktir. Bütün CMA substratlarında KFERQ adı verilen pentapeptit motif dizileri bulunmaktadır [11]. KFERQ motifi içeren hedef proteinler, kimyasal şaperonlar tarafından katlanmamış hale getirildikten sonra lizozoma yönlendirilirler. Lizozom lümeninde sindirime uğrarlar [12]. CMA, glikolitik enzimler, transkripsiyon faktörleri ve proteozom alt birimleri gibi birçok yapıyı yıkabilme özelliğine sahiptir [13]. KFERQ motifi içeren proteinler tanınmasında ısı şok proteinleri (HSPA8/HSC70) rol oynamaktadır [14]. HSPA8, substratı lizozom membranına iletir ve substrat da CMA subtrat reseptörü olan lizozomal ilşkili membran protein 2A’ya bağlanır [15]. Bu yolla substrat, lizozom lümenine geçmiş olur.
- Glick, D., Barth, S., & Macleod, K. F. (2010). Autophagy: cellular and molecular mechanisms. The Journal of Pathology, 221(1), 3–12. doi:10.1002/path.2697
- Kim, K. H., & Lee, M.-S. (2014). Autophagy—a key player in cellular and body metabolism. Nature Reviews Endocrinology, 10(6), 322–337. doi:10.1038/nrendo.2014.35
- Parzych, K. R., & Klionsky, D. J. (2014). An Overview of Autophagy: Morphology, Mechanism, and Regulation. Antioxidants & Redox Signaling, 20(3), 460–473. doi:10.1089/ars.2013.5371
- Marzella L, Ahlberg J, and Glaumann H. Autophagy, heterophagy, microautophagy and crinophagy as the means for intracellular degradation. Virchows Arch B Cell Pathol Incl Mol Pathol 36: 219–234, 1981.
- Sahu R, Kaushik S, Clement CC, Cannizzo ES, Scharf B, Follenzi A, Potolicchio I, Nieves E, Cuervo AM, and Santambrogio L. Microautophagy of cytosolic proteins by late endosomes. Dev Cell 20: 131–139, 2011.
- Yang Z and Klionsky DJ. An overview of the molecular mechanism of autophagy. Curr Top Microbiol Immunol 335: 1–32, 2009.
- Hayashi-Nishino M, Fujita N, Noda T, Yamaguchi A, Yoshimori T, and Yamamoto A. A subdomain of the endoplasmic reticulum forms a cradle for autophagosome formation. Nat Cell Biol 11: 1433–1437, 2009
- Ravikumar B, Moreau K, Jahreiss L, Puri C, and Rubinsztein DC. Plasma membrane contributes to the formation of pre-autophagosomal structures. Nat Cell Biol 12: 747–757, 2010.
- Takahashi Y, Meyerkord CL, Hori T, Runkle K, Fox TE, Kester M, Loughran TP, and Wang HG. Bif-1 regulates Atg9 trafficking by mediating the fission of Golgi membranes during autophagy. Autophagy 7: 61–73, 2011
- Hailey DW, Rambold AS, Satpute-Krishnan P, Mitra K, Sougrat R, Kim PK, and Lippincott-Schwartz J. Mitochondria supply membranes for autophagosome biogenesis during starvation. Cell 141: 656–667, 2010.
- Dice JF. Peptide sequences that target cytosolic proteins for lysosomal proteolysis. Trends Biochem Sci 15: 305–309, 1990.
- Orenstein SJ and Cuervo AM. Chaperone-mediated autophagy: molecular mechanisms and physiological relevance. Semin Cell Dev Biol 21: 719–726, 2010.
- Arias E and Cuervo AM. Chaperone-mediated autophagy in protein quality control. Curr Opin Cell Biol 23: 184–189, 2011.
- Chiang H-L, Terlecky SR, Plant CP, and Dice JF. A role for a 70-kilodalton heat shock protein in lysosomal degradation of intracellular proteins. Science 246: 382–385, 1989.
- Agarraberes FA and Dice JF. A molecular chaperone complex at the lysosomal membrane is required for protein translocation. J Cell Sci 114: 2491–2499, 2001.
Görsel Kaynak: https://www.behance.net/gallery/12470329/Inside-Cells-Molecular-Biology-and-Biochemistry
Editör: İrem Ezgi Ustaoğlu






